1. ¿Se puede utilizar una columna quiral Kromasil AmyCoat o CelluCoat tanto en modo de fase normal como de fase inversa?
Sí, las columnas pueden funcionar en condiciones de fase normal, modo polar y fase inversa. Las columnas regulares están empaquetadas para proporcionar la mayor eficiencia posible de la columna en condiciones de fase normal y modo polar (alcohol o acetonitrilo, sin alcano). Se pueden convertir a la fase inversa mediante etanol al 100% o isopropanol como disolvente intermedio. Por supuesto, las columnas también se pueden reacondicionar al modo original. Al convertir la columna, se observará una pérdida en la eficiencia de la columna al comparar el recuento de placas en el modo RP vs. NP. Para uso regular en condiciones de RP, recomendamos la compra de columnas empaquetadas que brinden la mayor eficiencia posible en condiciones de fase reversa, AmyCoat RP y CelluCoat RP.
2. ¿Se puede operar la columna con una fase móvil 100% acuosa?
Las columnas Kromasil de fase inversa C4, C8 y C18 deben funcionar con al menos un 5% de modificador orgánico. En condiciones 100% acuosas, es probable que las columnas experimenten deshumectación, lo que significa que la fase móvil será expulsada del sistema poroso debido a la tensión superficial. En este caso, los analitos eluyen más o menos con el volumen vacío. El problema surge principalmente si se detiene el flujo. Si una columna se ha deshumedecido, se puede restaurar fácilmente bombeando la fase móvil con al menos un 50% de modificador orgánico a través de la columna durante aproximadamente 40 min.
Kromasil C18 (w) es una variante de fase especializada que es totalmente compatible con condiciones 100% acuosas. Obtenga más información al respecto en la página del producto.
3. ¿Cómo se puede maximizar la vida útil de la columna?
El taponamiento de columnas es responsable de más de la mitad de todas las fallas de columnas. Por lo tanto, la filtración completa (0,2 μm) de las fases móviles y las muestras es clave para una larga vida útil de la columna.
La compatibilidad de la fase móvil es otro factor importante. Las fases estacionarias RP estándar son estables a un pH de 1,5 a 9. En determinadas condiciones (tampones orgánicos), las fases estacionarias son incluso químicamente estables hasta pH 12. Consulte con nuestro soporte técnico si desea utilizar su columna Kromasil clásica a valores de pH superando el pH 9. Generalmente, los tampones orgánicos son más suaves frente a la fase estacionaria a base de sílice que los inorgánicos, tales como fosfatos o carbonatos. Si necesita ejecutar su método a pH alto, elija Kromasil EternityXT, que es estable hasta pH 12.
Además, las columnas nunca deben dejarse en una fase móvil tamponada cuando el flujo se interrumpe durante más de 10 minutos. Elija un caudal muy bajo (0,1 ml / min para una columna de 4,6 mm de DI) en lugar de detener el flujo por completo, o cambie cualquier fase móvil tamponada por una no tamponada (p. Ej., Agua / acetonitrilo 70/30). Esto evitará que la columna se obstruya con sales tampón precipitadas.
4. ¿Cómo se puede comprobar el rendimiento de la columna?
El rendimiento se comprueba mejor volviendo a ejecutar la separación que se muestra en el cromatograma de prueba adjunto. Se mencionan las condiciones exactas. La cantidad de muestra no debe exceder las siguientes cantidades:
| Ø de columna [mm ID] | muestra de prueba [µg] |
| 2.1 | 2 |
| 4.6 | 10 |
| 10 | 50 |
| 21,2 | 225 |
5. ¿Cómo se pueden limpiar / regenerar las columnas?
Una contrapresión aumentada, tiempos de retención alterados y pérdida de rendimiento de la columna son síntomas de depósitos en la columna o en la superficie de la fase estacionaria. La mayoría de las veces, estos problemas pueden superarse mediante el uso de un procedimiento de lavado correctamente aplicado. Lo que también debe tenerse en cuenta es que en la mayoría de los casos, cuanto antes se realice el lavado (regeneración) de la columna, mejor.
Las especies fuertemente adsorbidas se recogen en el extremo de la columna de entrada de disolvente y, en muchos casos, es una ventaja utilizar un flujo inverso durante el lavado. Vale la pena mencionar que una columna bien empaquetada no debe perder rendimiento como resultado de un flujo inverso.
RP (fases hidrofóbicas)
Los depósitos se presentan más comúnmente como especies adsorbidas en la superficie o precipitaciones.
| Ejemplos de disolventes recomendados: | ||
| Sospecha de deposición / impureza | Disolventes recomendados | Ejemplos de |
| Lipohílico | Disolventes fuertemente lipofílicos | Al, Tol |
| Polar (péptidos pequeños) | Disolventes versátiles | DCM, THF, DMF |
| Fuertemente polar / iónico (sol. De agua) | Disolventes acuosos | 50:50 DMF / w, THF / w |
| Polar, cargado positivamente (aminas) | Mezclas supresoras de intercambio iónico | DMF / AA (1%), DMF / TFA (0,1%) |
| Deposiciones macromoleculares (precipitaciones de proteínas / péptidos grandes) | Mezclas que rompen fuertemente la interacción | DMF / 1% SDS (aq), ACN / 1% SDS (aq), Alc / AA, Alc / NEt3 (0,1%) Alc / NaOH acuoso 10-100 mM * |
| Precipitaciones de sal / tampón | Mezclas muy acuosas | Alc (10%) / p |
Al = alcanos,
Tol = tolueno,
DCM = diclorometano,
THF = tetrahidrofurano,
DMF = dimetilformamida,
AA = ácido acético,
TFA = ácido trifluoroacético,
ACN = acetonitrilo,
Alc = alcohol (MeOH, EtOH),
w = agua,
NEt3 = trietilamina ,
SDS = Decilsulfato de sodio
* Utilizar como última medida para no más de 10 volúmenes de columna, terminar también acidificando la fase en Alc / AA acuoso al 1% 50:50.
Para lograr un recuento de placas representativo, es importante reducir los volúmenes de columna adicionales, por ejemplo, se debe instalar el tubo correcto entre la inyección y la columna y desde la columna hasta el detector.
5. ¿Cómo se pueden limpiar / regenerar las columnas?
Una contrapresión aumentada, tiempos de retención alterados y pérdida de rendimiento de la columna son síntomas de depósitos en la columna o en la superficie de la fase estacionaria. La mayoría de las veces, estos problemas pueden superarse mediante el uso de un procedimiento de lavado correctamente aplicado. Lo que también debe tenerse en cuenta es que en la mayoría de los casos, cuanto antes se realice el lavado (regeneración) de la columna, mejor.
Las especies fuertemente adsorbidas se recogen en el extremo de la columna de entrada de disolvente y, en muchos casos, es una ventaja utilizar un flujo inverso durante el lavado. Vale la pena mencionar que una columna bien empaquetada no debe perder rendimiento como resultado de un flujo inverso.
RP (fases hidrofóbicas)
Los depósitos se presentan más comúnmente como especies adsorbidas en la superficie o precipitaciones.
| Ejemplos de disolventes recomendados | ||
| Sospecha de deposición / impureza | Disolventes recomendados | Ejemplos de |
| Lipohílico | Disolventes fuertemente lipofílicos | Al, Tol |
| Polar (péptidos pequeños) | Disolventes versátiles | DCM, THF, DMF |
| Fuertemente polar / iónico (sol. De agua) | Disolventes acuosos | 50:50 DMF / w, THF / w |
| Polar, cargado positivamente (aminas) | Mezclas supresoras de intercambio iónico | DMF / AA (1%), DMF / TFA (0,1%) |
| Deposiciones macromoleculares (precipitaciones de proteínas / péptidos grandes) | Mezclas que rompen fuertemente la interacción | DMF / 1% SDS (aq), ACN / 1% SDS (aq), Alc / AA, Alc / NEt3 (0,1%) Alc / NaOH acuoso 10-100 mM * |
| Precipitaciones de sal / tampón | Mezclas muy acuosas | Alc (10%) / p |
Al = alcanos,
Tol = tolueno,
DCM = diclorometano,
THF = tetrahidrofurano,
DMF = dimetilformamida,
AA = ácido acético,
TFA = ácido trifluoroacético,
ACN = acetonitrilo,
Alc = alcohol (MeOH, EtOH),
w = agua,
NEt3 = trietilamina ,
SDS = Decilsulfato de sodio* Utilizar como última medida para no más de 10 volúmenes de columna, terminar también acidificando la fase en Alc / AA acuoso al 1% 50:50.
Protocolo de regeneración:
- Elija una mezcla de disolvente / disolvente según la impureza. Si no se conoce, suponga especies fuertemente polares / iónicas para evitar una mayor precipitación.
- Utilice un caudal bajo (10% del caudal normal), posiblemente en modo de flujo inverso y a temperaturas ligeramente elevadas (<40 ° C), para hasta diez volúmenes de columna.
- Si tiene problemas con la contrapresión, verifique ocasionalmente el progreso a flujo normal.
- Si el problema persiste, aplique condiciones para deposiciones polares, cargadas positivamente y / o macromoleculares. Si se usa SDS, lavar a fondo con THF puro, DMF o ACN después.
- Si los problemas persisten, consulte con nuestro soporte técnico para obtener más consejos.
NP (fases polares)
Para las fases polares, especialmente la sílice desnuda, es común una adsorción muy fuerte de residuos polares. Aunque en condiciones de fase normal no se eluyen impurezas muy polares, la solución a esto es el uso de altos niveles de disolventes próticos, posiblemente en combinación con ácido.
Si hay problemas con tiempos de retención alterados, primero verifique el equilibrio fase – agua (humedad). El uso de solventes secos podría «secar» gradualmente la fase estacionaria, dando como resultado tiempos de retención alterados. Esto es especialmente ruda para la sílice desnuda.
Protocolo de regeneración?
- Equilibre la columna usando un solvente mediador acuoso-lipófilo como THF.
- Utilice un caudal bajo (caudal normal del 10%) de alcohol puro (MeOH), posiblemente en combinación con ácido (ácido acético o ácido fórmico, 1-5%), hasta diez volúmenes de columna.
- Si el problema persiste, utilice una mezcla de alcohol y agua, con ácido añadido, en las mismas condiciones que en 2.
- Como medida final: 0,5-1,5% de NH3 (ac), seguido de 0,5-1,5% de ácido acuoso (HCl, AA, etc.), agua, alcohol, THF y finalmente el eluyente real.
- Si los problemas persisten, consulte con nuestro soporte técnico para obtener más consejos.
?: Al utilizar disolventes altamente polares, especialmente para la sílice pura, la estabilización del sistema después del lavado podría llevar una cantidad de tiempo significativa. Esto se debe a que se distorsiona el equilibrio del agua y la superficie de la sílice.
6. ¿Cómo se debe preparar una fase móvil tamponada?
Las fases móviles almacenadas en búfer se pueden preparar básicamente de dos formas:
- preparar el tampón, incluido el ajuste del pH antes de mezclarlo con el modificador orgánico.
- tampón de mezcla y modificador orgánico antes del ajuste del pH.
Si bien el pH es un parámetro bien definido en sistemas acuosos, no es tan sencillo definir o medir la concentración de protones en sistemas de disolventes parcialmente orgánicos.
Por tanto, se recomienda preparar el tampón acuoso, ajustar el pH, filtrarlo a través de 0,4 µm y luego mezclarlo con el modificador orgánico. Se debe prestar atención a los siguientes puntos:
- los tampones son efectivos dentro de +/- 1 unidad de pH de su pKA ⇒ elija el sistema de tampón correcto
- considerar el riesgo de precipitación si se mezclan altas concentraciones de tampón con disolventes orgánicos
- Filtre siempre los tampones a través de un filtro de 0,4 mm antes de su uso
- ser consciente del riesgo de crecimiento bacteriano o fúngico en tampones acuosos puros
- el pH generalmente cambia con la adición de un modificador orgánico (el pH aumenta para los tampones inorgánicos (por ejemplo, fosfatos) y disminuye para los tampones orgánicos (por ejemplo, acetatos)
Ejemplo: tampón de fosfato pH 7,6 ⇒ adición de 40% de MeOH ⇒ pH 8,5
7. ¿Cómo se deben almacenar las columnas?
El almacenamiento correcto de la columna es un requisito previo para una cromatografía sin problemas y una larga vida útil de la columna. Las columnas de fase normal deben almacenarse en heptano / 2-propanol u otro solvente inerte que esté libre de aditivos.
Las fases estacionarias de fase inversa deben mantenerse en una mezcla de agua / modificador orgánico, libre de tampones o aditivos que puedan precipitar durante el almacenamiento. Por tanto, se recomienda lavar la columna siempre que se vaya a detener la cromatografía durante más de 15 min con agua / modificador orgánico 50/50, independientemente de si la columna se desprenderá del instrumento de HPLC o no. Si la cromatografía solo se va a interrumpir durante un par de horas, podría ser menos laborioso mantener el tampón que contiene la fase móvil funcionando a un caudal muy bajo. Si la columna está desprendida, cerrar la entrada y la salida con un tornillo para evitar que se seque la fase estacionaria.
Todas las columnas de HPLC deben almacenarse a temperatura ambiente (18-26 ° C), sin riesgo de choque mecánico, preferiblemente en la caja de la columna original.
8. No encuentro el cromatograma de prueba de mi columna Kromasil.
Con cada columna de Kromasil, en el recuadro de la columna, se proporciona un cromatograma de prueba individual que muestra la eficiencia en condiciones de prueba estándar. Si se pierde, se puede solicitar una copia de este cromatograma de prueba mediante un formulario de solicitud específico .
Palabras clave: Cromatograma de prueba, Certificado de análisis, CoA
9. ¿Qué puede causar tiempos de retención deficientemente reproducibles?
1. Composición de la fase móvil
Los resultados más reproducibles se obtienen pesando las mezclas de la fase móvil. Para agua / etanol 30/70 (v / v), se mezclan 300,0 g (300 ml x 1,0 g / ml) de agua con 546,0 g (700 ml x 0,78 g / ml) de etanol.
Especialmente cuando se trabaja con alcoholes como modificador polar, se debe evitar la mezcla en línea con las bombas de HPLC, ya que la viscosidad de los componentes varía significativamente y dificulta la mezcla adecuada.
Las fases móviles siempre deben prepararse frescas, ya que la evaporación alterará la composición de una fase móvil de dos componentes.
2. Cambio de temperatura
Una diferencia de 5 ° C puede generar un cambio de +/- 10% en los tiempos de retención. Por tanto, se recomienda trabajar con un horno de columna incluso cuando se trabaja a temperatura ambiente.
3. Control de pH
El tiempo de retención de los analitos ácidos y básicos depende del valor del pH. 0.1 unidades de pH pueden representar un cambio en el tiempo de retención en un 10%. Por lo tanto, se recomienda trabajar a un valor de pH de al menos 2 unidades de pH del pKA.
4. Equilibrio incompleto
Se recomienda equilibrar las columnas de fase reversa con al menos 10 volúmenes de columna, para fases móviles tamponadas con al menos 20 volúmenes de columna antes de iniciar un análisis. Asegúrese de que todos los canales de la fase móvil estén purgados con la fase móvil adecuada. Las columnas de fase normal pueden requerir tiempos de equilibrio hasta 10 veces más largos que las columnas de fase reversa. Las columnas de sílice desnudas pueden tardar horas en equilibrarse; se debe prestar especial atención al contenido de agua en los sistemas de fase normal. Los resultados más reproducibles se obtienen a menudo cuando se añade deliberadamente un 0,05% de agua a la fase móvil.
5. Deshumedecimiento
Las fases móviles altamente polares pueden ser expulsadas del sistema poroso hidrófobo, lo que conduce a un área superficial cada vez menos accesible y, por lo tanto, provoca tiempos de retención cada vez más cortos. Ver también: «¿Se puede operar la columna con una fase móvil 100% acuosa?».
10. ¿Qué significa el tope final?
El remate final describe el proceso de reacción de grupos silanol que no se han derivatizado, por ejemplo, octadecilclorosilano. El reactivo de protección final es generalmente un silano más pequeño (por ejemplo, trimetilclorosilano) que se usa para reaccionar con algunos de los grupos hidroxilo residuales. Este tratamiento reduce la cantidad de grupos silanol disponibles que pueden sufrir interacciones a menudo no deseadas con analitos polares o cargados.
11. ¿Qué significa HILIC?
HILIC significa cromatografía líquida de interacción hidrófila y es una técnica utilizada para separar sustancias altamente polares. También se puede describir como cromatografía en fase normal acuosa. La fase estacionaria debe ser de carácter polar, por ejemplo, sílice, diol, amina, amida o bipolar. Como fase móvil, generalmente se usan mezclas de acetonitrilo / agua, donde el agua es el componente fuerte, exhibiendo así una mayor fuerza de elución que el acetonitrilo. Por tanto, HILIC es una subcategoría de la cromatografía de fase normal y muestra un patrón de elución opuesto al de la fase inversa.
12. ¿Qué es el problema de «colapso de fase / humectabilidad»?
El uso de fases móviles con bajo contenido de modificador orgánico (<5%) conduce generalmente a lo que se conoce como «colapso de fase». Este último se describe mejor como un fenómeno de deshumectación, en el que la fase móvil altamente acuosa se excluye del sistema de poros hidrófobos debido a la tensión superficial. El efecto se observa predominantemente con materiales de relleno de fase inversa con alta densidad de ligando (> 3,2 µmol / m 2 ). La pérdida de superficie mojada da como resultado una disminución en los sitios de interacción accesibles para el soluto y conduce a una pérdida de retención y / o una capacidad de carga reducida. El proceso se puede revertir fácilmente purgando el lecho empacado con un alto contenido de modificador orgánico (> 50%) El fenómeno es más dominante para los materiales de empaque C18 y C8 con poros <150 Å, pero incluso con materiales de empaque C4 modificados, 100% Deben evitarse las fases móviles acuosas para asegurar una cromatografía robusta.
Kromasil C18 (w) es una variante de fase especializada que es totalmente compatible con condiciones 100% acuosas. Obtenga más información al respecto en la página del producto .
13. ¿Cuál es el caudal adecuado para una determinada columna?
Para cada tamaño de partícula, existe un caudal lineal óptimo con respecto a la eficiencia de la columna, según el gráfico de van Deemter.
| Caudal óptimo (ml / min) para columnas Kromasil en función del tamaño de partícula y el diámetro de la columna. | |||||
| 3,5 µm | 5 µm | 10 µm | 13 µm | 16 µm | |
| Tasa de flujo lineal (cm / min) | 7.1 | 4,7 | 3.3 | 2.4 | 1,9 |
| ID de 2,1 mm | 0,3 | 0,2 | – | – | – |
| DI de 4,6 mm | 1,5 | 1.0 | 0,7 | 0,5 | 0.4 |
| DI de 10 mm | – | 4,7 | 3,7 | 2.4 | 1,9 |
| ID de 21,2 mm | – | 21 | 15 | 10 | 8.5 |
Sin embargo, para tiempos de separación más cortos, el caudal se puede aumentar hasta que se alcance el límite de caída de presión de la bomba de HPLC, por ejemplo, aproximadamente 400 bar.
14. ¿Cuál es la diferencia entre volumen muerto y volumen de permanencia?
El volumen muerto también puede denominarse volumen de columna adicional y consiste en el volumen de un sistema de HPLC entre el punto de inyección y el punto de detección, pero excluyendo la columna en sí. Por tanto, incluye el volumen de inyección, el volumen del inyector, el volumen del tubo de conexión antes y después de la columna, el volumen de los terminales y fritas, y el volumen de la celda de flujo del detector. El volumen muerto se puede medir reemplazando la columna con un conector de volumen cero. Al inyectar una cantidad de muestra muy pequeña, se puede medir el tiempo entre el momento de la inyección y la altura máxima del pico. Este tiempo multiplicado por el caudal le da una buena estimación del volumen muerto del sistema.
El volumen de permanencia o el volumen de permanencia del gradiente es responsable del retardo de tiempo del gradiente. Describe el volumen de un sistema de HPLC en gradiente entre la cámara de mezcla y la entrada de la columna. Por supuesto, este volumen también existe bajo elución isocrática, pero en ese caso, no tiene ningún impacto en la separación. El volumen de permanencia del gradiente comprende el volumen del mezclador de gradiente, la tubería de conexión a la bomba, el cabezal de la bomba y las válvulas de retención, la tubería entre la bomba y el inyector, el inyector en sí y la tubería entre el inyector y la columna. entrada. Cuando se inicia un gradiente, la columna no se somete al cambio en la composición del eluyente hasta que el gradiente ha pasado el volumen de permanencia. Durante ese tiempo, la columna se hace funcionar bajo elución isocrática. Se debe prestar atención al transferir un método de gradiente de un instrumento a otro. Si el volumen de permanencia difiere, es probable que los tiempos de retención también difieran, a pesar de un método y una columna idénticos. El volumen de permanencia se puede medir ejecutando un gradiente escalonado de metanol al 100% a metanol al 100% + acetofenón 10 mg / L. El detector de UV detectará un rastro de detector en forma de S. El volumen de permanencia es igual al tiempo entre la inyección y la mitad de la altura de la traza del detector, multiplicado por el caudal.
15. ¿Cuál es la diferencia entre HPLC en fase reversa (RP) y cromatografía de interacción hidrofóbica (HIC)?
En ambos casos, la fase estacionaria es más hidrófoba que la fase móvil. La hidrofobicidad de las fases estacionarias de RP es generalmente más alta que la de los medios HIC. La elución en RP se obtiene ajustando la polaridad de la fase móvil con un disolvente miscible en agua, por ejemplo, un alcohol o acetonitrilo. La elución tiene lugar en isocrático (concentración de modificador constante) o en condiciones de gradiente (aumento de la concentración de modificador).
Los medios HIC tienen un carácter hidrófobo más débil y la elución se induce al disminuir la polaridad en la fase móvil en virtud de una disminución en la concentración de sal. El HIC se aplica generalmente en separaciones de proteínas, donde la exposición a disolventes orgánicos durante un tiempo prolongado puede inducir un despliegue irreversible, por lo tanto, la pérdida de la actividad biológica de las proteínas.
Para fines analíticos, RP-HPLC es un método indiscutible cuando se trata de separar sustancias estrechamente relacionadas, incluidas las proteínas.
16. ¿Cuál es el límite de caída de presión para sus fases estacionarias quirales (CSP)?
¡Prácticamente no hay ninguno! Tanto los CSP basados en polisacáridos Kromasil AmyCoat y CelluCoat, como los CSP basados en un polímero de red reticulado, Kromasil TBB y DMB, se basan en esferas de sílice porosas altamente estables mecánicamente, producidas internamente. Además, el método de recubrimiento patentado para las fases basadas en polisacáridos hace que estos CSP sean altamente resistentes a las fuerzas hidrodinámicas. Por lo tanto, todas las CSP de Kromasil pueden funcionar con una contrapresión de hasta 400 bar. Aprovechar todo el rango de caída de presión de los instrumentos de HPLC clásicos permite un análisis rápido y, además, un equilibrio de columna muy eficiente a velocidades de flujo elevadas.
17. ¿Qué es el solvente de envío?
El disolvente de envío se indica en el cromatograma de prueba y depende de la modificación de la superficie de la fase estacionaria.
18. ¿Qué se debe hacer si la contrapresión aumenta?
Cuando se bombea la fase móvil a través de un lecho en particular, se producirá una cierta caída de presión δP sobre la columna. La relación entre el diámetro de partícula d p y la velocidad de flujo u viene dada por la ley de Darcy para disolventes no comprimibles:
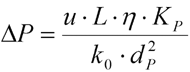
En consecuencia, δP es proporcional a la velocidad lineal u , las longitudes de columna L y la viscosidad de la fase móvil η , e inversamente proporcional a la constante k 0 y al cuadrado del diámetro de partícula d p . La constante k 0 es función de la porosidad intersticial ε i según la ecuación de Karman-Cozeny:
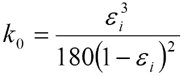
La ecuación anterior muestra que la porosidad intersticial ε i tiene una tremenda influencia sobre la permeabilidad del lecho y con ello también sobre la caída de presión. Para una fase inversa bien empaquetada, se puede suponer que la porosidad intersticial es 0.33, lo que conduce a k 0 = 4.45.10-4. La permeabilidad de la columna ( d p 2 · k 0 ) depende en la práctica enteramente del diámetro de partícula y de la distribución del tamaño de partícula. Este último es un parámetro muy importante, ya que las partículas de un material de empaque de HPLC nunca son mono-dispersas.
La amplia distribución tiene dos efectos negativos:
- las partículas más grandes controlan la eficiencia y
- las partículas más pequeñas controlan la caída de presión.
Por tanto, debe evitarse una amplia distribución del tamaño de partículas.
19. ¿Qué tipo de tubos / capilares y conectores se deben utilizar?
Tubo capilar
Cuando se trabaja con instrumentos de HPLC analítica, generalmente se utilizan capilares con un diámetro externo de 1/16 «(1,6 mm) para conectar las diferentes partes del instrumento. Aquellas partes que no afectan el volumen extra de la columna deben tener diámetros internos (DI) de 1 mm. Aportan poco riesgo de obstrucción y muestran una mínima resistencia al flujo, lo que contribuye a la caída de presión adicional de la columna. Para aquellas conexiones críticas para el volumen extra de la columna, se recomienda un diámetro interno de 0,17 mm. Dichos capilares añaden solo 23 μL extra volumen por metro de tubería (tubería de 1,0 mm de DI: 800 μL / m) Para evitar la obstrucción de estos capilares finos, es de suma importancia filtrar tanto las fases móviles como las soluciones de muestra.
Para las columnas preparativas, la tubería debe ampliarse para reducir la resistencia al flujo causada por los caudales más altos (δP cap ≈d cap -4 ):
| Tamaños de tubería para tamaños de columna | |
| ID de columna mm | Tubería ID mm |
| 20 | 0,25 |
| 50 | 0,5 |
| 100 | 1.0 |
Guarniciones
Los accesorios conectan las distintas partes del instrumento de HPLC. Los accesorios de acero suelen tener un casquillo separado, algunos diseños incluso utilizan dos casquillos, un anillo y una pieza cónica. Cuando se aprieta por primera vez, la férula se pellizca de forma permanente y el capilar rodeado se comprime ligeramente. La férula ya no se puede quitar del capilar. Los accesorios de plástico (PEEK) son de una sola pieza (tuerca, férula) y se instalan apretando con los dedos únicamente. Se debe evitar apretar demasiado (común con accesorios de acero), ya que es probable que una fuerza excesiva dañe la rosca y el capilar. Se recomienda apretar el tornillo solo ligeramente con una llave y probar si la conexión es resistente a la presión, lo que significa que no se producen fugas una vez que la fase móvil se bombea a través del sistema.
La distancia desde el extremo del tubo hasta el extremo inferior de la férula depende del diseño de la columna y / o del instrumento. A continuación se dan algunos ejemplos:
- 0.130 «en el caso de columnas Waters
- 0,80 «para el diseño de Valco
- 0.170 «para el diseño de inyector Rheodyne
20. ¿Cuándo se recomienda una columna de guardia?
Una columna de protección puede resultar útil si la muestra de inyección consta de una matriz compleja con contenido parcialmente desconocido. Sin embargo, una columna de protección nunca hace que la filtración de muestras sea redundante. Si una columna de protección debe proporcionar una protección adecuada para la columna analítica, debe cambiarse con la suficiente frecuencia para evitar que se deteriore el rendimiento de la columna. Al monitorear el número de placa (N), la presión y la resolución (Rs), se puede evaluar el rendimiento de la columna de guarda, así como de la columna analítica, y se puede elegir un momento adecuado para cambiar la columna de guarda.
Como regla general, la columna de protección debe reemplazarse cuando se aplique uno de los siguientes puntos:
- N disminuye en> 10%
- la caída de presión aumenta en> 10%
- Rs cambia en> 10%
- se inyectan más de 150 muestras.
Lea más sobre cómo ordenar y manejar guarda columnas en la página de guarda columnas.
21. ¿Cuándo se debe utilizar un gradiente?
En HPLC de fase inversa, se recomienda ejecutar un gradiente de exploración si se desconocen las condiciones para una separación exitosa. Tal corrida se realiza a partir de aproximadamente un 10-80% de modificador orgánico durante 30-50 min, usando un aumento lineal en la fuerza de elución. Basándose en el resultado de este gradiente de exploración, se puede elegir una composición de fase móvil apropiada para la elución isocrática (moléculas pequeñas <1000 g / mol) o un gradiente adecuado para la separación de péptidos u otras moléculas más grandes.
También se puede elegir elución en gradiente para la separación de compuestos que varían mucho en su polaridad. Como regla general, si se pueden detectar picos durante más del 25% del gradiente de exploración, la elución del gradiente probablemente será la mejor opción para ese problema de separación. Si aparecen picos para menos del 25% del gradiente de exploración, se debe preferir la elución isocrática, ya que la selectividad siempre será superior en condiciones isocráticas.
Si la muestra consta de dos grupos distintos de compuestos, el paso de elución puede conducir a buenos resultados de separación. En este caso, se comienza con la elución de la fase móvil isocrática que produce resultados de separación satisfactorios para el grupo de compuestos menos retenido, seguido de un aumento de la fuerza de elución de la fase móvil en un paso hasta tal punto que separará el grupo de compuestos más retenido en una forma apropiada. Los gradientes escalonados también se pueden utilizar para lavar la columna después de cada inyección. En este caso, la fuerza de elución aumenta drásticamente después de que ha eluido el último pico. Las impurezas fuertemente retenidas se pueden eliminar de la columna.
22. ¿Cuáles son los tampones habituales que se utilizan en HPLC?
| Tampones de pH | ||||
| Sal | pK A | Rango de pH del tampón | equilibrio | Corte de rayos ultravioleta |
| Acetato de amonio | 4,76 9,2 | 3.8-5.8 8.2-10.2 | HAc ↔ Ac – NH 4 + ↔ NH 3 | 205 |
| Formiato de amonio | 3.8 9.2 | 2.8-4.8 8.2-10.2 | HCOOH ↔ HCOO – NH 4 + ↔ NH 3 | 200 |
| Fosfato de potasio | 2,1 7,2 | 1.1-3.1 6.2-8.2 | H 3 PO 4 ↔ H 2 PO 4 – H 2 PO 4 – ↔ HPO 4 2− | 190 |
| Acetato de trietilamonio | 4,76 11,01 | 3.8-5.8 10.-12.0 | HAc ↔ Ac – Et 3 NH + ↔ Et 3 N | 235 |
Aditivos | ||||
| Sal | pK A | Rango de pH del tampón | equilibrio | Corte de rayos ultravioleta |
| Ácido acético | 4,76 | – | HAc ↔ Ac – | 205 |
| Ácido fórmico | 3.8 | – | HCOOH ↔ HCOO – | 200 |
| Ácido trifluoroacético | 0,3 | – | F 3 CCOOH ↔ F 3 CCOO – | 210 |
| Trietilamina | 11.01 | – | Et 3 NH + ↔ Et 3 N | 235 |
| Dietilamina | 10,5 | – | Et 2 NH 2 + ↔ Et 2 HN | 235 |
| Hidróxido de amonio | 9.2 | – | NH 4 + ↔ NH 3 | 190 |
23. ¿Qué columna quiral debería utilizarse?
Es casi imposible prever qué fase estacionaria quiral proporcionará la mayor selectividad para un determinado racemato. Algunos racematos comunes que pueden separarse mediante nuestra columna quiral se pueden encontrar en la guía de aplicación . Si la estructura de su compuesto es similar a los compuestos que se muestran en la guía de aplicación, es muy probable que la misma columna / fase móvil también proporcione separación enantiomérica para su compuesto.
Kromasil AmyCoat y CelluCoat son fases estacionarias que son muy generales, por lo que proporcionan separación para la mayoría de los racematos. Estas dos columnas se pueden utilizar en condiciones de fase normal, modo polar y fase inversa. Para aplicaciones de fase inversa, se deben utilizar columnas RP específicas. Kromasil AmyCoat y CelluCoat se basan en polisacáridos modificados que se adsorben en una matriz de sílice. Debe prestarse atención a la elección de los disolventes de fase móvil para evitar la desorción del polímero polisacárido.
Los mejores resultados se obtienen a menudo cuando se usa un modificador polar aprótico, por ejemplo, éteres o ésteres en combinación con heptano. Para los racematos básicos, los aditivos ácidos y básicos a menudo conducen a mejoras significativas en la forma de los picos. El aditivo ácido (por ejemplo, ácido fórmico o ácido acético) debe usarse en exceso, por ejemplo, 0,1% de ácido y 0,05% de amina (DEA o TEA).
Para obtener información detallada sobre nuestras columnas quirales, consulte nuestros folletos quirales .
24. ¿Qué celda de flujo del detector debo usar para mi columna?
Para obtener la mejor sensibilidad posible, es importante trabajar con la combinación correcta de celda de flujo / columna. Los sistemas de HPLC estándar están optimizados para columnas de ID de 4,0 a 4,6 mm. Si se utilizan columnas de ID más pequeñas, es probable que la celda de flujo del detector estándar contribuya al volumen de columna adicional hasta tal punto que se vea comprometida la eficiencia máxima. La siguiente tabla indica combinaciones de celdas de flujo del detector y dimensiones de columna:
| ID de columna [mm] | Tasa de flujo típica [mL / min] | Volumen de la celda de flujo [μL] |
| 4.6 | 1.0 | 13-15 |
| 4.0 | 0,75 | 13-15 |
| 3,0 | 0,5 | 5-9 |
| 2.1 | 0,2 | 5-9 |
| 1.0 | 0,05 | 1-2 |
25. ¿Qué producto Kromasil corresponde a la nomenclatura de columna de la USP?
| USP | Descripción | Productos Kromasil |
| L1 | Octadecil silano unido químicamente a sílice porosa | Kromasil 100 Å C18 Kromasil 300 Å C18 Kromasil Eternity C18 Kromasil EternityXT C18 |
| L3 | Micropartículas de sílice porosa | Kromasil 60 Å SIL Kromasil 100 Å SIL Kromasil 300 Å SIL |
| L7 | Octilsilano unido químicamente a sílice porosa | Kromasil 100 Å C8 Kromasil 300 Å C8 |
| L8 | Una capa esencialmente monomolecular de aminopropilsilano unida químicamente a sílice totalmente porosa. | Kromasil 100 Å NH2 |
| L10 | Grupos de nitrilo unidos químicamente a micropartículas porosas de sílice | Kromasil 60 Å CN |
| L11 | Grupos fenilo unidos químicamente a partículas porosas de sílice | Kromasil 100 Å Fenil Kromasil Eternidad fenilhexilo Kromasil EternityXT fenilhexilo |
| L13 | Trimetilsilano unido químicamente a micropartículas de sílice porosa | Kromasil 100 Å C1 |
| L26 | Butil silano unido químicamente a partículas de sílice totalmente porosas | Kromasil 100 Å C4 Kromasil 300 Å C4 |
26. ¿Qué fases móviles funcionan con mi longitud de onda de detección?
Ciertos tampones o disolventes orgánicos interfieren con la detección de rayos ultravioleta. Solo las fases móviles con un corte de UV por debajo de la longitud de onda de detección no comprometerán la sensibilidad de la señal.
Las tablas siguientes muestran el corte de UV de los tampones, disolventes y aditivos más utilizados en HPLC.
| valor de pH | Buffer | Corte de UV [nm] |
| 2.0 – 3.0 | Fosfato | 210 |
| 3,5 – 5,5 | Acetato | 240 |
| 4.0 – 6.0 | Citrato | 250 |
| 6,0 – 8,5 | Fosfato | 210 |
| 7.0 – 9.0 | TRIS | 225 |
| 8,0 – 10,5 | Borato | 210 |
| Solvente | Corte de UV [nm] |
| Acetona | 330 |
| Acetonitrilo | 190 |
| Diclorometano | 233 |
| Dimetoxi sulfóxido | 268 |
| Dioxano | 215 |
| Etanol | 210 |
| Acetato de etilo | 256 |
| Hexano | 195 |
| Heptano | 200 |
| Metanol | 205 |
| Metiletilcetona | 329 |
| Metil t-butil éter | 210 |
| N, N-dimetilformamida | 268 |
| Propan-2-ol (IPA) | 205 |
| Tetrahidrofurano | 210 |
| Tolueno | 284 |
| Aditivo | Corte de UV [nm] |
| Ácido acético | 230 |
| Dietilamina | 210 |
| Ácido fórmico | 210 |
| Trietilamina | 235 |
| Ácido trifluoroacético | 210 |
27. ¿Por qué el cromatograma muestra colas de picos?
El colapso de los picos puede ocurrir debido a numerosas razones. El problema se puede identificar de acuerdo con el siguiente esquema:
- Sobrecarga de masa: cuando se inyecta menos cantidad de muestra (masa), el pico se vuelve más simétrico o se resuelve en dos picos separados.
Acción correctiva: use una muestra de inyección más diluida.
- Interacciones secundarias: al inyectar un compuesto neutro (acetofenona, tolueno) el pico se vuelve simétrico
Acción correctiva: ajustar el pH de la fase móvil para que los analitos sean neutros.
Para columnas de ID más grandes (> 10 mm), el gradiente de temperatura radial también puede causar colas en los picos. Para evitarlo, se recomienda utilizar un horno de columna. La columna debe estar 1-2 ° C más caliente que la fase móvil para compensar el calor de fricción generado en el núcleo de la columna.
Si no se aplica nada de lo anterior, el relave también puede ser causado por irregularidades en el proceso de empaquetamiento de la columna o por una frita de entrada parcialmente obstruida que conduce a un perfil de flujo no homogéneo.
28. ¿Por qué el cromatograma muestra poca eficiencia (recuento de placas)?
1. Cantidad de inyección / volumen de inyección
La sobrecarga de masa o volumen, así como el disolvente de muestra incorrecto, pueden reducir significativamente la eficacia de la columna y, por tanto, perjudicar los resultados de la separación. El volumen de inyección no debe exceder el 10% del caudal (p. Ej., 1 ml / min? Volumen de inyección <100 µL. La sobrecarga de masa se obtiene tan pronto como se supera la parte lineal de la isoterma de adsorción. Este límite es individual, pero como Como regla general, no se deben cargar más de 0,01 mg de muestra por ml de volumen de columna (p. ej., un máximo de 22 µg en una columna de 4,6 × 250 mm). Sin embargo, la masa de la muestra puede aumentarse si es necesario por motivos de detección. En el disolvente de la muestra, la cantidad del componente fuerte de la fase móvil (alcohol, acetonitrilo en RP, o alcohol, acetato de etilo, etc. en NP), no debe exceder la cantidad en la fase móvil.
2. Volumen de columna adicional / volúmenes muertos
Los recuentos deficientes en placa a menudo se pueden atribuir a un volumen muerto excesivo. El volumen muerto se define como la suma del volumen aportado por el inyector de muestra, incluido el bucle de muestra, el tubo que conecta el inyector de muestra a la columna, el tubo que conecta la columna a la celda de flujo del detector, la celda de flujo del detector, más cualquier volumen agregado por accesorios, conectores y filtros en línea. Los tubos con un DI de 0.010 «se encuentran comúnmente en los sistemas de HPLC. Si está utilizando columnas de diámetro interior estrecho (<3.0 mm DI), o, puede mejorar el rendimiento de su sistema reemplazando el tubo de 0.010» DI por un tubo de DI de 0.007 «para reducir volumen muerto del sistema. Los tubos con un diámetro interior de 0,005 «pueden reducir aún más el volumen muerto, pero a costa de inconvenientes. Los tubos con diámetros internos inferiores a 0,007 «restringen la velocidad de flujo y pueden tener problemas con la precipitación de sal tampón. Si utiliza una variedad de marcas de columnas de HPLC, asegúrese de que los accesorios utilizados para conectar a la columna coincidan correctamente. Si su sistema tiene tubería y accesorios de acero, seleccione los accesorios adecuados para cada marca de columna que utilice e instale esos accesorios antes de conectar la columna. Si su sistema tiene tubería y accesorios de PEEK, es una buena idea instalar un nuevo accesorio de PEEK en un nuevo corte un trozo de tubería de PEEK con cada cambio de columna para asegurar un ajuste adecuado.
29. ¿Por qué el cromatograma muestra picos divididos?
Los picos divididos pueden ser causados por:
- Contaminación de la columna
- Frita parcialmente tapada
- Columna vacía
- Efectos de los disolventes de inyección
- Compuestos coeluyentes
La contaminación de la columna o las fritas parcialmente obstruidas se producen generalmente cuando se inyectan muestras sin filtrar o cuando el disolvente de la muestra es diferente a la fase móvil. En este último caso, los componentes de la muestra pueden precipitar en la entrada de la columna al mezclarse con la fase móvil o al entrar en contacto con la superficie metálica de la frita.
Un vacío de columna se forma por estrés hidrodinámico (alto caudal, alta viscosidad de la fase móvil) de una columna mal empaquetada, por impacto mecánico (la columna se dejó caer al piso) o por disolución química del material de empaque, por ejemplo, pH > 12.
Cuando se utilizan disolventes de inyección que tienen una fuerza de elución superior a la de la fase móvil, pueden aparecer picos más anchos o división de la fase móvil. El efecto es más pronunciado para los picos de elución temprana.
Los picos divididos también pueden ocurrir por dos compuestos que están casi coeluyendo. Si este es el caso, los picos deberían separarse mejor si se usa una columna con mayor eficiencia (platos teóricos). Esto se puede lograr mediante un tamaño de partícula más pequeño o una columna más larga. Además, una temperatura más alta y / o una fase móvil menos viscosa pueden promover una mejor separación.
Además, un compuesto puede eluir en dos estados, por ejemplo, si no está presente suficiente reactivo de apareamiento de iones en la fase móvil o si la capacidad tampón es deficiente.
30. ¿Por qué es difícil obtener tiempos de retención reproducibles en cromatografía de fase normal?
La razón de la variabilidad en el tiempo de retención en HPLC de fase normal es la fuerte dependencia de la retención del contenido de constituyentes de fase móvil altamente polares, especialmente agua. Incluso si no se añade agua a la fase móvil a propósito, siempre se disolverán pequeñas cantidades incluso en disolventes muy apolares. Además, la sílice desnuda es extremadamente higroscópica, por lo que el agua se adsorberá en la superficie. Por lo tanto, el contenido de agua en un sistema de fase normal puede variar significativamente y rara vez se controla. Los mejores resultados, por ejemplo, tiempos de retención reproducibles, se obtienen cuando se trabaja con fases móviles semisaturadas. Una forma sencilla de obtener una fase móvil medio saturada es dividir la fase móvil en partes iguales. A una parte (por ejemplo, 500 ml), se le agregan 2-3 ml de agua y se deja agitar la mezcla durante unos 30 min. Posteriormente se retira el exceso de agua (embudo de decantación) y se añade la parte seca (500 mL) a la porción saturada.
Incluso si una fase móvil medio saturada reducirá en gran medida el tiempo para alcanzar el equilibrio en la columna. El equilibrio de una columna de fase normal, especialmente cuando se trata de sílice desnuda, puede llevar horas. Además, las fases estacionarias modificadoras polares, tales como ciano o diol, son generalmente mucho menos propensas a variaciones en el contenido de agua de la fase móvil y pueden equilibrarse más rápidamente.
Algunos ejemplos de datos de solubilidad del agua en disolventes orgánicos a 25 ° C:
- Heptano: 0,0091% (p / p)
- Acetato de etilo: 2,94% (p / p)
- Tolueno: 0.0334% (p / p)
- MTBE: 1,50% (p / p)
